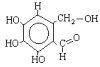
As aminas são compostos orgânicos definidos como derivados da amônia (NH3). As aminas são classificadas como: primárias, secundárias e terciárias.
Aminas primárias
As aminas primárias derivam do NH3 através da substituição de 1H por um radical originado no hidrocarboneto.
Vejamos:
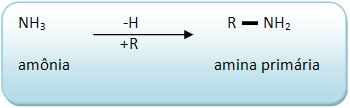
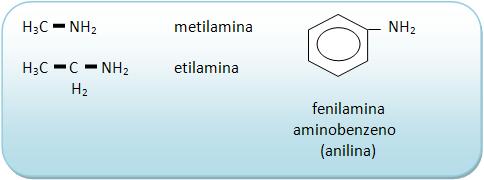
As aminas primárias apresentam o grupo – NH2, denominado amino.
Na nomenclatura, dá-se o nome do grupo – R e logo em seguida da palavra amina.
A putrescina (1,4-diaminobutano)
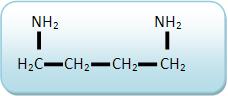
A cadaverina (1,5-diaminopentano)
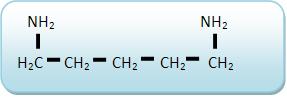
Tanto a putrescina quanto a cadaverina são processos que resultam da putrefação de cadáveres.
A amina mais importante recebe o nome de anilina, que é fundamental na indústria de corantes.
As aminas primárias derivam do NH3 através da substituição de 1H por um radical originado no hidrocarboneto.
Vejamos:

As aminas primárias apresentam o grupo – NH2, denominado amino.
Na nomenclatura, dá-se o nome do grupo – R e logo em seguida da palavra amina.

A putrescina (1,4-diaminobutano)

A cadaverina (1,5-diaminopentano)

Tanto a putrescina quanto a cadaverina são processos que resultam da putrefação de cadáveres.
A amina mais importante recebe o nome de anilina, que é fundamental na indústria de corantes.
Aminas secundárias
As aminas secundárias derivam do NH3 através da substituição de 2H por dois radicais derivados de hidrocarboneto.
Vejamos:
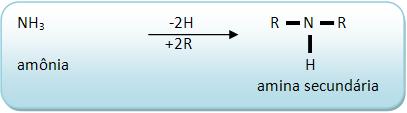
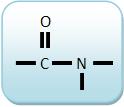
As aminas secundárias sempre apresentam o grupo
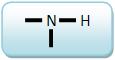
que está ligado à dois grupos R ( ou R e R’).
As aminas secundárias derivam do NH3 através da substituição de 2H por dois radicais derivados de hidrocarboneto.
Vejamos:

As aminas secundárias sempre apresentam o grupo

que está ligado à dois grupos R ( ou R e R’).
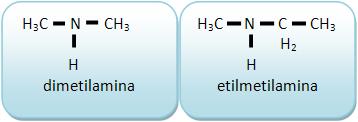
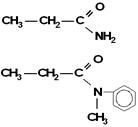
As aminas terciárias derivam do NH3 através da substituição dos 3H por três radicais derivados de hidrocarbonetos.
Vejamos:
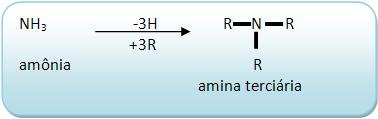
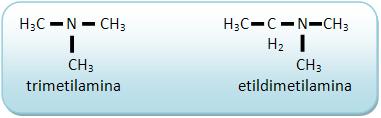
As aminas terciárias não possuem H ligado diretamente a nitrogênio.
A trimetilamina ocorre com a putrefação de peixes.






.jpg)